Anmerkung: Der aktuelle Anlass für diesen Artikel ist eine Veröffentlichung auf einem US-Blog, die auf WUWT auszugsweise wiedergegeben, und dann von EIKE als Übersetzung publiziert wurde. Im Zentrum stehen Betrügereien mit pH-Werten von Meerwasser. Was zunächst mit dem englischen Wortspiel „pHraud“ bezeichnet wurde, lässt sich gut ins deutsche Wortspiel „pHälschung“ übertragen. Hier gehen wir auf die physikalischen, chemischen und biologischen Fakten ein, schauen uns diese pHälschung nochmal genauer an, und suchen (vergeblich) nach Belegen für die Gefahren von CO2 im Meerwasser. Dabei fällt die Wechselwirkung zwischen pH, Temperatur und CO2 auf.
Kohlendioxid (CO2) ist in der globalen Atmosphäre einigermaßen gleichmäßig verteilt (s. auch Abbildung) und bleibt es, ganz anders als Wasserdampf, der sich gelegentlich zu einer Wolke wandelt, oder gar als Regen wieder auf die Erde zurück kommt.
An Land nutzen die Pflanzen das CO2 als Gas direkt aus der Luft und stellen per Photosynthese daraus die Kohlenhydrate Zucker, Stärke und Zellulose her. Es ist essentiell für alles Leben auf Erden. Das Pflanzenwachstum, und damit die weltweite landwirtschaftliche Produktion von Nahrungsmitteln, würde sogar von einem Mehrfachen der heutigen CO2 Konzentrationen profitieren. Allerdings sei das CO2 in der Atmosphäre für die per Computermodell vorhergesagte „katastrophale Erwärmung“ der Erde verantwortlich (was jedoch in realen Messdaten nicht sichtbar wird).
Im Wasser wird es komplizierter. Zunächst einmal wird das CO2 im Wasser physikalisch gelöst, so wie man Salz oder Zucker in Wasser auflösen kann und wie auch andere Gase gelöst werden. Bekanntermaßen ist auch Sauerstoff (O2) im Wasser physikalisch gelöst und die Fische können über ihre Kiemen diesen Sauerstoff „einatmen“. Auch Wasserpflanzen, wozu auch Mikroalgen gehören, können mit dem gelösten CO2 Photosynthese betreiben.
Anders als bei O2 reagiert jedoch eine kleine Menge (~1%) des zunächst physikalisch gelösten CO2 mit dem Wasser chemisch unter Bildung von „Kohlensäure“, wodurch das Wasser saurer wird.
In noch einem weiteren chemischen Schritt geschieht die Karbonatbildung; überwiegend in der Form von Calciumcarbonat (CaCO3, Kalkstein). Dies kann als chemischer Prozess ablaufen, der nichts mehr als die Gegenwart von Calcium-Ionen und Kohlensäure benötigt, wobei das gebildete, schwer lösliche Calciumcarbonat ausfällt und auf den Meeresboden absinkt. Oder es kann ein biologischer Prozess sein, bei dem Korallen, Muscheln und andere Organismen ihre harten Schalen bilden, und nach ihrem Absterben Teil der Kalksteinschicht werden. Über lange Zeiträume und nachfolgende geologische Verwerfungen führt dies zur Bildung von Kalksteingebirgen.
Allerdings ist dieser Schritt, chemisch wie auch biologisch, nur bis zu einem bestimmten Säuregrad möglich; ist das Meerwasser wesentlich saurer könnte er sogar rückwärts laufen, und eine Auflösung des Kalks zur Folge haben. Entsprechend fatal wären die Konsequenzen für die davon abhängigen Organismen.
Den Säuregrad misst man als pH-Wert, was relativ einfach zu machen ist.
Was eigentlich ist pH-Wert? Und was ist Säure?
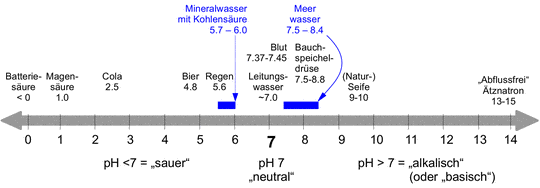
Wasser ist bekanntlich H2O und ein energetisch stabiles Molekül, das man nur unter Energiezufuhr (z.B. Elektrolyse mit elektrischem Strom) zerlegen kann. Aber etwa jedes 100 Millionste Wassermolekül dissoziiert (zerfällt) auf natürliche Weise in die elektrisch positiv bzw. negativ geladenen Ionen H+ und OH- [1]). Diese Ionen haben dann beide eine Konzentration von 10-7 mol pro liter Wasser. Der pH-Wert [2]) ist somit 7 ( = der negative Wert des Exponenten der H+ Ionen Konzentration). An diesem Punkt ist Wasser neutral. Gibt es mehr H+ Ionen, dann ist die Flüssigkeit eine Säure, der pH-Wert ist kleiner als 7. Im anderen Fall von weniger H+ Ionen Konzentration ist die Flüssigkeit eine Lauge, der pH-Wert ist größer als 7.
Sprachlich ist zu beachten, dass eine Säure „sauer“ ist, aber eine Lauge „alkalisch“ [3]).
Beispiele für pH-Werte
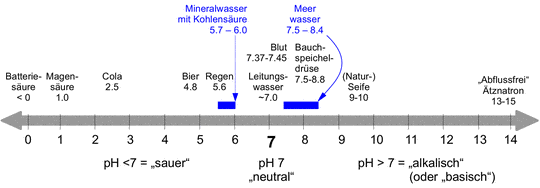
Um ein Gefühl für pH-Werte aus unserem täglichen Leben zu bekommen, sind in Abbildung ein paar pH-Werte gezeigt. Leitungswasser ist meist (aber nicht unbedingt) nahe dem Neutralpunkt. Auf der sauren Seite folgen Regen, Bier, Cola, Magensäure und Batteriesäure. Letztere kann auch negative pH-Werte haben. Auf der alkalischen Seite folgen Blut, Bauchspeicheldrüsensekret, Naturseife, und ganz extrem Ätznatron oder darauf basierende „Abflussreiniger“, die Fette und Proteine (Haare bestehen aus Proteinen) auflösen können.
Auch wenn unser Körper von Verdauungstrakt bis Hautoberfläche einen Bereich von pH=1 bis pH=10 verträgt – das ist immerhin ein 1 Milliarden-facher Unterschied bezogen auf die H+ Ionen Konzentration – toleriert unser Blut dagegen nur äußerst enge Grenzen von pH=7.37-7.45 [4]), also im leicht alkalischen Bereich. Werte außerhalb dieses sehr schmalen Bereiches sind bereits krankhaft!
|
Abbildung SEQ Abbildung * ARABIC1: pH-Wert Skala |
Zellkulturen, die gerne als Wundertechnologie zum Ersatz von Tierversuchen zur Prüfung von Medikamenten gepriesen werden, oder die zur biotechnologischen Herstellung von Medikamenten wie Immunglobulinen eingesetzt werden, wollen in ihrer Nährlösung einen pH-Wert innerhalb des immer noch engen Bereiches von 7.0-7.4 haben, also neutral bis ebenfalls leicht alkalisch. Andere Mikroorganismen können bei anderen pH-Werten existieren – Backhefe z.B. um pH=5 (also sauer). Für optimales Wachstum werden eher enge pH Bereiche benötigt, wenngleich tendenziell die Organismen um so toleranter sind, je primitiver sie sind.
Es ist daher zunächst einmal durchaus denkbar, dass die heutzutage im Wasser lebenden Tiere sich evolutionär so an ihre Umgebung angepasst haben, dass sie nunmehr sehr empfindlich auf pH Veränderungen reagieren!
Wie beeinflusst CO2 den pH-Wert von Wasser?
Ist (Mineral-)Wasser mit CO2 versetzt (umgangssprachlich: „mit Kohlensäure“), ist es erwartungsgemäß saurer als Leitungswasser. Überraschenderweise ist aber Meerwasser alkalisch, obwohl es doch angeblich durch das CO2 der Atmosphäre versauert.
Der Grund liegt in dem chemischen Verhalten von CO2 im Wasser. Die folgende chemische Gleichung zeigt das Gleichgewicht von im Wasser gelöstem CO2 (links) zur Kohlensäure (H2CO3), die sofort in das Hydrogencarbonat- und Wasserstoff-Ion dissoziiert, und schließlich zum Carbonat-Ion und weiteren Wasserstoff-Ionen. Die Verteilung der Komponenten auf die einzelnen Stufen zwischen links und rechts hängt sehr stark von pH-Wert, Temperatur und den Konzentrationen der einzelnen Komponenten ab.
Damit besteht ein Puffersystem. 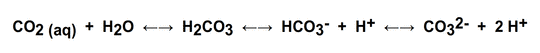 Im Zusammenwirken mit weiteren, zum Teil ebenfalls puffernden, Bestandteilen des Meerwassers (eine Vielzahl verschiedener Salze in deutlich höherer Konzentration als im Leitungswasser, sowie diverse organische Komponenten) kann die Pufferwirkung verstärkt, und der pH Wert verschoben werden.
Im Zusammenwirken mit weiteren, zum Teil ebenfalls puffernden, Bestandteilen des Meerwassers (eine Vielzahl verschiedener Salze in deutlich höherer Konzentration als im Leitungswasser, sowie diverse organische Komponenten) kann die Pufferwirkung verstärkt, und der pH Wert verschoben werden.
Im Fall von Meerwasser ist der pH in den leicht alkalischen Bereich verschoben. Die Pufferung bedeutet weiter, dass die den pH verschiebenden Substanzen – wie CO2 – nicht zur vollen Wirkung gelangen können. Nehmen wir an, dass eine bestimmte Menge CO2 den pH von Leitungswasser um 1 Einheit saurer macht, dann könnte die gleiche Menge CO2 den pH von Meerwasser, dank dessen Pufferung, möglicherweise nur um Werte verschieben, die wesentlich geringer oder gar unmessbar klein sind. Diese Pufferwirkung ist auch der Grund, weswegen der pH Wert im Blut überhaupt in seinem sehr engen Bereich gehalten werden kann.
Da Meerwasser aber sehr komplex ist, weltweit in seiner Zusammensetzung variieren kann, und das ganze System dann auch noch von Temperatur und Druck (durch die Meerestiefe) abhängig ist, ist es höchst schwierig, die Auswirkungen einer CO2 Erhöhung theoretisch vorherzusagen.
Klimaforscher haben es dennoch getan, und wie wir sehen werden, scheitern sie auch mit diesen Ozean pH Modellen so eklatant, wie sie es mit der Vorhersage der Globalen Erwärmung tun.
Was sagen die „Klimaforscher“ zur „Versauerung“ der Ozeane?
Der Amerikaner Richard A. Feely und seine Mitarbeiter haben sich insbesondere mit Arbeiten zur angeblichen Ozeanversauerung hervorgetan. In der Publikation „CO2 und unser Ozean Vermächtnis“ (2006), die von der amerikanischen Ozean und Atmosphären Behörde (NOAA, National Oceanic and Atmospheric Administration)
|
Abbildung SEQ Abbildung * ARABIC2: Historischer und vorhergesagter Trend von pH und gelöstem CO2 des Meerwassers |

Demnach ist der pH seit dem Beginn der industriellen Revolution um 1850 bis heute gleichmäßig von 8.16 auf 8.05 gesunken, und wird bis 2100 auf pH=7.85 sinken. Weiter führen sie aus, wie verheerend sich dies auf die Meereslebewesen auswirken wird, und wie verheerend dies dann für die Menschen sein wird.
Diese verheerenden Wirkungen kämen daher, dass Meeresorganismen bei zu niedrigem pH keine Schalen und/oder Skelette aus Calciumcarbonat mehr bilden könnten, und dann nicht mehr als Nahrung für höhere Organismen zur Verfügung stünden. So könnten substantielle Änderungen in der Biodiversität der Ozeane resultieren, die letztlich den Fischfang bedrohen und damit die menschliche Nahrungsversorgung und die gesamte damit zusammenhängende Wirtschaft, und ebenso den milliardenschweren Tourismus, und alle an diesen Industrien hängenden Arbeitsplätze. Weiter werden verschwindende Korallenriffe die Küsten stärker den Stürmen aussetzen, mit wiederum gravierenden Folgeschäden. Bereits in der Mitte dieses Jahrhunderts wird es beginnen.
Gegenwärtig, so die Autoren, verändere sich die Meeres Chemie „100mal schneller als in den vergangenen 650 000 Jahren“ und „Computer Modelle (!) zeigen, dass der Ozean mit seiner Versauerung fortfahren wird und zwar in einem Ausmaß und in Geschwindigkeiten, wie sie seit mehreren 10 Millionen Jahren nicht stattfanden“.
Man beachte, dass selbst in der Vorhersage für das Jahr 2100 ein pH von 7.85 oder gar 7.65 [5]) nicht sauer ist, sondern immer noch alkalisch! Das Wort Meeres-Versauerung (engl.: Ocean Acidification) suggeriert ätzende Säuregrade von Essig oder gar Batteriesäure – dem ist beileibe nicht so.
Aber es bleibt immerhin denkbar, dass Meeresorganismen bereits mit diesen leichten Veränderungen der pH Werte Probleme bekommen, selbst wenn diese noch nicht einmal im sauren, sondern noch immer im alkalischen Bereich liegen.
|
Abbildung SEQ Abbildung * ARABIC3: CO2 in Atmosphäre und Meerwasser und pH des Meerwassers |
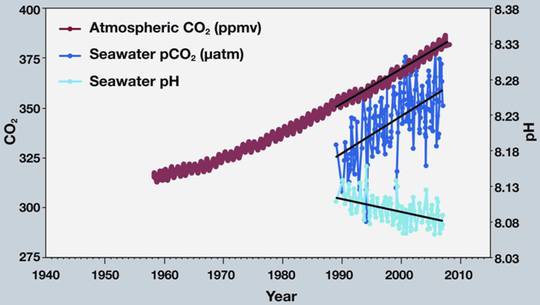
Die Messdaten, die Feely’s Klimamodell-Kurven bestätigen sollen, finden sich ebenfalls auf den NOAA Servern, und sind in Abbildung gezeigt. Die wellige, braune Kurve stellt die bekannten atmosphärischen CO2 Werte dar, wie sie von der Messstation auf dem Vulkan Mauna Loa auf Hawaii gemessen werden. Die dunkelblaue Kurve zeigt den Partialdruck des Meerwasser CO2, also der im Meerwasser gelösten Menge an CO2. Die hellblaue Kurve zeigt den daraus angeblich resultierenden pH im Meerwasser. Der hätte danach von pH=8.112 im Jahre 1989 auf pH=8.081 in 2007, also um 0.03 pH Einheiten abgenommen (Werte von mir aus der Grafik abgelesen. Die durch die Skala suggerierte Messung von hundertstel pH Einheiten im Meer ist gewiss als „sehr sportlich“ zu bezeichnen; nicht einmal im Labor ist das einfach!)
Es fällt auf, dass die NOAA Daten erst 1989 beginnen. Moderne pH Messungen werden mit Glaselektroden durchgeführt, und da diese bereits seit etwa 100 Jahren bekannt sind, ist das Fehlen früherer Messungen besonders merkwürdig. Das fiel auch dem Amerikaner Mike Wallace auf, der Feely und Kollegen um die fehlenden Daten bat. Die dann folgende Odyssee von ignorieren, bedrohen, verweigern und belügen können Sie in dem bereits eingangs erwähnten Artikel nachlesen.
Auch hier beim Meeres-pH wurde die Herausgabe der Daten verweigert, am Ende gar mit der Behauptung, dass sie nicht existierten. Letztlich tauchten sie aber – wohl eher unbeabsichtigt – durch die Freigabe einer Datenbank durch NOAA auf. Aus diesen mehr als 1.5 Mio (!) Messdaten entwickelte Wallace die in Abbildung gezeigte Kurve.
|
Abbildung SEQ Abbildung * ARABIC4: Meeres pH seit 2010 basierend auf NOAA Daten |
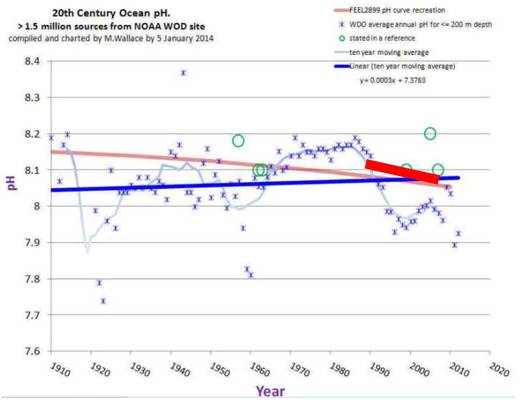
Die Sternchen stellen die jährlichem pH Mittelwerte der letzten 100 Jahre für Meerestiefen bis 200m dar. Die dünne, hellblaue Kurve ist der gleitende Mittelwert über 10 Jahre. Die dicke, dunkelblaue Kurve gibt den 100 Jahre Trend. Die blass-rote Kurve ist die rote pH Kurve aus der Feely Grafik in Abbildung. Die kurze, dicke, rote Kurve ist von mir eingezeichnet, und stellt die Regressionsgerade der hellblauen pH Daten aus Abbildung dar.
Daraus können folgende Schlussfolgerungen gezogen werden:
- Die pH Veränderungen, die nach Feely die größten seit 650 000 Jahren seien, sind kleiner als die in gerade einmal den letzten 100 Jahren mehrfach beobachteten.
- Die Schnelligkeit der Veränderungen der Feely Daten ist nicht etwa 100mal schneller als seit 650 000 Jahren beobachtet, sondern beträchtlich langsamer als Veränderungen mit ca. 10 Jahren Zeitkonstante in den letzten 100 Jahren.
- Über den 100 Jahre Zeitraum nimmt der pH nicht etwa ab, sondern im Mittel nimmt er zu. Mithin also keine „Versauerung“, sondern das Gegenteil!
- Da der CO2 Gehalt der Atmosphäre erst seit 1950 kräftig gestiegen ist, müsste die Kurve vor und nach diesem Zeitpunkt ein anderes Verhalten zeigen. Das tut sie aber nicht. Der pH Wert ist heute so niedrig, wie um 1920 oder auch 1960, und dazwischen jeweils deutlich höher.
- Die pH Veränderungen, die NOAA auf ihrer Webseite zeigt ( Abbildung) sind lächerlich klein und bedeutungslos angesichts der Schwankungen, die tatsächlich über 100 Jahre gemessen wurden.
- Die Computermodelle liegen wieder einmal kräftig daneben.
Der Vorgang erinnert in nahezu jedem Detail ungemein an die Climategate Ereignisse, wie die Behauptung, dass die Erde für Jahrtausende konstante Temperaturen – jetzt eben pH Werte – hatte, und diese erst in der Neuzeit verrückt spielen, und die Verweigerung der Preisgabe von Daten, die Rosinen Pickerei in den Daten, die Geheimhaltung von ausgewählten Teilen der Daten, die nicht passten, die Behauptung der Nicht-Existenz der Daten, die Verleihung von gut dotierten „Wissenschaftspreisen“ – dort der Nobelpreis, hier der Ketchup-Preis [6]) – , das Ignorieren von Freedom-of-Information-Act Anfragen, der Vehemenz, mit der die Herausgabe von Daten verweigert wurde, die Bedrohungen der danach fragenden Wissenschaftler, die Nutzung von Computermodellen, die die Vorhersagen selbstverständlich mit „einem hohen Maß von Zuverlässigkeit“ vorhergesagt haben, und mehr.
Feely et al. und/oder NOAA haben sehr klar durch die Selektion der Daten für den kurzen Zeitraum von nur knapp 20 Jahren, dabei nicht einmal zu erwähnen, dass längerfristige Daten vorliegen, in Verbindung mit der nahezu maßlosen quantitativen Übertreibung angeblicher Folgeeffekte, was Ihnen durch Kenntnis der weggelassenen Daten klar sein musste, eine mehrfache wissenschaftliche Fälschung begangen, eben eine pHälschung!
Der Climategate Skandal wird nun also ergänzt mit dem Acidificationgate Skandal. Interessant könnte es noch werden, da Feely auch als Zeuge vor dem US-Kongress ausgesagt, und dabei die gleichen Falschaussagen gemacht hat. Belogen zu werden hat der Kongress nicht gerne, obwohl politische Korrektheit auch dort für viel Weißwascherei sorgt. Nun aber werden die Republikaner demnächst die Majorität stellen und sind zum „Klimawandel“ wesentlich skeptischer eingestellt, als die Demokraten. Schaun mer mal.
Wie reagieren denn nun die Meerestiere auf pH Änderungen?
Vor lauter Klimaaktivismus sind Feely et al. doch wenig substantiell geblieben, wenn es darum geht, diese angeblich verheerenden Auswirkungen mit Daten zu belegen. Es wäre aber doch schön, könnte man feststellen, ob überhaupt und wenn ja, wie, Meerestiere auf pH Veränderungen reagieren und wo die Grenzen liegen.
Angesichts der bereits beobachteten pH Schwankungen, die so groß oder größer sind, als die aus Klimamodellen erwarteten und dem bisherigen Überleben der Meeresfauna und -flora kann man zunächst wohl nur sagen, dass trotz pH Schwankungen der letzten 100 Jahre innerhalb des ganzen, als verheerend behaupteten Bereichs, verheerende Auswirkungen nicht beobachtet wurden. Prüfen wir aber ein paar weitere Daten.
Dazu schauen wir uns eine Karte der Meeres pH Werte ( Abbildung) an, gemessen im Februar 2005. Gemäß Farbskala wird der Bereich von 7.74 bis 8.40 abgedeckt, also wiederum der gesamten „verheerenden“ Bereich. Folglich gilt nicht nur, dass der pH zeitlich über Jahre in diesem Bereich schwankt, auch zu jedem Zeitpunkt scheint es Unterschiede der gleichen Größe je nach Meeresregion zu geben.
|
Abbildung SEQ Abbildung * ARABIC5: Karte der Meeres pH Werte (Februar 2005) |
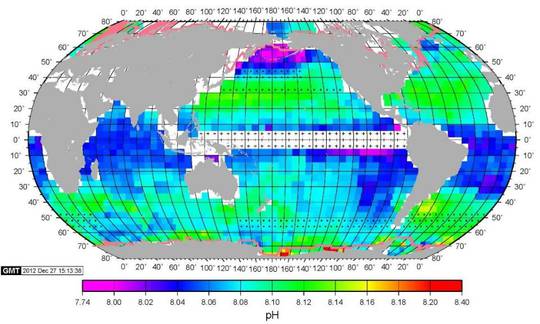
Quelle: Columbia’s Lamont-Doherty Earth Observatory
Dabei sind regionale Unterschiede auffällig: In Äquatornähe sieht man ein pH Band von etwa 8.03-8.05. Nördlich und südlich Bänder um 8.08-8.14, homogener im Norden als im Süden. Ganz im Norden dann die niedrigsten Werte bis herunter zu 7.74, und ganz im Süden die höchsten bis 8.40. Aus dem Text kann man entnehmen, dass dies typisch für Winter auf der Nord-Halbkugel ist, und die in dieser Messung extremen pH Werte im Norden bzw. Süden sich durch die jeweiligen Temperaturen einstellen. Mithin schwanken die pH Werte um so mehr, je näher man den Polen kommt.
Macht es angesichts dieser globalen Unterschiede überhaupt Sinn, einen mittleren globalen pH-Wert zu bestimmen?
Dass die pH Werte in der Wärme höher sind als in der Kälte finden auch Ajioka et al. [7]) bei Messungen an einem Süßwasser See. Ein Auszug der Daten ist in Abbildung gezeigt. Im Winter wird an der Oberfläche bei ~8°C ein pH von 7.6 erreicht, im Sommer bei ~26°C ein pH von 8.8. Mit zunehmender Wassertiefe zeigen Temperaturen und pH geringer werdende Schwankungen, und nehmen in etwa die Winterverhältnisse an.
|
Abbildung SEQ Abbildung * ARABIC6: Sommer, Winter pH und T Messungen an einem See |
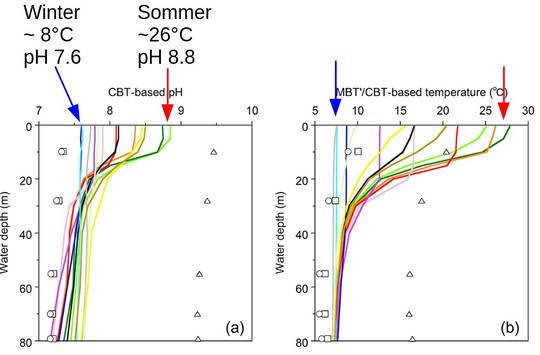
Das heißt dann aber auch, dass die Wasserorganismen, im Meer oder im Süßwasser, aber am Ort ihres Aufenthalts, im jahreszeitlichen Wechsel pH Schwankungen von sogar mehr als dem „verheerenden“ Bereich erfahren.
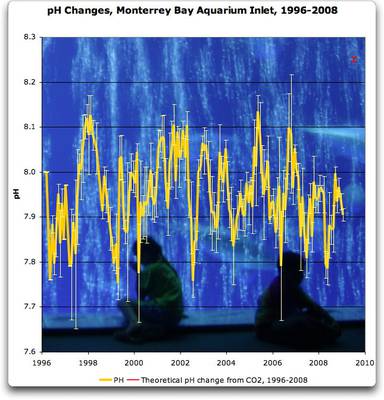
Das Monterey Bay Meerwasser Aquarium (Kalifornien, USA) misst seit Jahren den pH Wert des aus dem Meer in das Aquarium eingeleiteten Wassers (Quelle von Daten, Abbildung). Den Verlauf zeigt Abbildung. Auch hier müssen die Organismen im Meer und im Aquarium mit pH Schwankungen von 7.75 bis 8.15 leben, wiederum so groß wie der „verheerende“ Bereich!
Offenkundig zeigen die Beobachtungen, dass die Organismen pH Schwankungen im „verheerenden“ im Bereich gut verkraften, ob diese sich nun über Jahre hinweg ändern, über die Jahreszeiten, oder durch lokale, regionale, oder globale Besonderheiten bedingt sind.
Labortests
|
Abbildung SEQ Abbildung * ARABIC7: pH Werte Monterey Bay Aquarium 1996-2008 |
Um die Reaktion von Korallen auf erhöhte CO2 Werte zu messen, sind verschiedene Labor Studien gemacht worden. Es wurden z.B. Coccolithophore untersucht, die für ein drittel der marinen Kalksteinproduktion verantwortlich seien, und man fand, dass Kalkbildung und Produktivität bei höherer CO2 Konzentration signifikant höher war. In einer weiteren Studie fand man, dass die Koralle Lophelia pertusa sich in einigen Monaten an saurere Bedingungen anpassten und dann ebenfalls erhöhte Kalkbildung zeigte. Beide Male also das Gegenteil der Katastrophen-Behauptungen. Eine weitere Studie zeigte gemischte Ergebnisse, war allerdings so kurzfristig angelegt, dass möglicherweise noch keine Adaption der Meeres Organismen stattgefunden hatte. Es gibt noch viele weitere Studien [8]). Welche davon negative Effekte zeigte, trotz Berücksichtigung von Adaption, ist nicht einfach zu klären.
Historisch
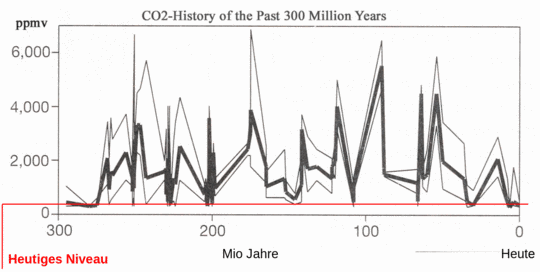
In den letzten 300 Mio Jahren betrug die CO2 Konzentrationen in der Atmosphäre bis zum 15fachen der heutigen Werte (s. Abbildung). Wenn erhöhtes CO2 durch Versauerung der Ozeane den kalkbildenden Organismen das Leben unmöglich gemacht hat, warum gibt es dann heute noch Kalksteingebirge und Fossilien mit Kalkschalen ?
|
Abbildung SEQ Abbildung * ARABIC8: CO2 in den letzten 300 Mio Jahren (kaltesonne.de) |
Riffe sind Klimasünder
Und noch ein weiterer Effekt macht Vorhersagen komplizierter: In einem Riff findet Photosynthese durch die Algen statt, wodurch CO2 verbraucht wird. Gleichzeitig findet aber auch die Kalkbildung statt, wodurch CO2 erzeugt wird!
Die Calcifizierungs Gleichung zeigt es:
Da Calcium 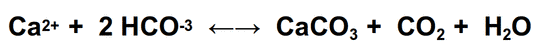 carbonat (CaCO3, Kalkstein) in Wasser schwer löslich ist, fällt es aus. Dabei wird CO2 freigesetzt! Tatsächlich sind vitale Riffe insgesamt Quellen von CO2 [9]), tragen also zum CO2 Anstieg in der Atmosphäre bei!
carbonat (CaCO3, Kalkstein) in Wasser schwer löslich ist, fällt es aus. Dabei wird CO2 freigesetzt! Tatsächlich sind vitale Riffe insgesamt Quellen von CO2 [9]), tragen also zum CO2 Anstieg in der Atmosphäre bei!
Ein gut wachsendes Riff ist ein Klimasünder. Was tun wir dagegen?
Temperaturen
Wie beobachtet sind niedrige pH Werte mit niedrigen Temperaturen und hohe pH Werte mit hohen Temperaturen assoziiert sind und wenn eine „Globale Erwärmung“ auch die Meere erwärmt, müsste man doch folglich eine pH Erhöhung erwarten, also eine Alkalisierung und eben nicht eine Versauerung! Das passt zu der Tatsache, dass sich CO2 in kaltem Wasser besser löst als in warmen – öffnen Sie spaßeshalber mal eine gut vorgewärmte Flasche Mineralwasser!
Nur ist es nicht einfach zu sagen, was der Netto Effekt ist zwischen einer CO2 Erhöhung in der Atmosphäre, die den pH-Wert des Meerwassers tendenziell absenkt, und einer CO2-Ausgasung des Meeres, weil durch Erwärmung die Löslichkeit von CO2 sinkt. Und wie das Puffersystem auf das gleichzeitige Verändern von CO2 und Temperatur regiert.
Im Originalartikel wird darauf hingewiesen, dass Wallace in einem noch kommenden Artikel eine Korrelation der pH Werte mit der PDO (Pazifisch Dekadischen Oszillation) zeigen wird (kann ich aus den Daten bisher nicht erkennen [10])). Das gäbe einen starken Hinweis darauf, dass die pH Werte tatsächlich primär temperaturabhängig schwanken.
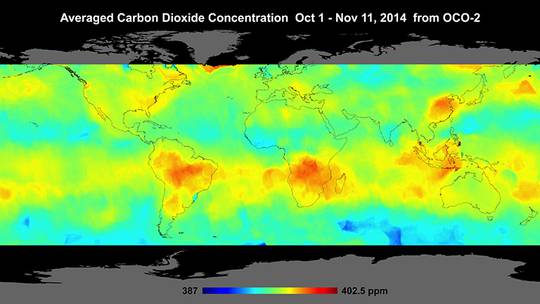
Für diese Vermutung sprechen auch die ersten Daten der amerikanischen OCO2 Satelliten Mission zur Messung der globalen CO2 Verteilung, gezeigt in Abbildung. Die mittlere CO2 Konzentration schwankt nur um ±2%, ist also tatsächlich global ziemlich konstant. Auffällig sind niedrige Konzentrationen über Europa, insbesondere UK und Irland, und hohe in der Südhalbkugel, einschließlich der Meere. Könnte es sein, dass die Emissionen von Industrie, Verkehr und Privathaushalten unbedeutend ist im Vergleich zu natürlichen Schwankungen? Und das die CO2 Ausgasungen auf den Meeren der Südhalbkugel – dort ist Frühling zur Zeit dieses Messungen – auf Erwärmung zurückzuführen sind?
Überhaupt könnte der CO2-Anstieg der letzten 160 Jahre durch Entgasung aus dem Ozean dank stärkerer Sonnenaktivität erklärt werden, wobei CO2 nicht die Ursache sondern die Folge einer Temperaturerhöhung ist (weiteres hier, hier, hier, und hier).
|
Abbildung SEQ Abbildung * ARABIC9: Globale CO2 Konzentration per Satellit (Okt/Nov 2014) |
Konklusion
- Feely et al. haben durch das selektive Verwenden von Daten – was ihnen offenkundig bekannt war – eine pHälschung begangen, und darauf aufbauend wilde Behauptungen über die Folgen eines CO2 Anstiegs für die Meeresbiologie angestellt
- Tatsächlich zeigen die Daten, dass Schwankungen um angeblich verheerenden Bereich normal, und in den letzten 100 Jahren mehrfach vorgekommen sind.
- Außerdem treten diese Schwankungen in Gewässern im jahreszeitlichen Rhythmus auf, wodurch sich auch zumindest ein Teil der globalen Schwankungen erklären lässt.
- Zumindest einige der potentiell betroffenen Organismen können sich adaptieren, und haben dann sogar Vorteile von einer solchen angeblich verheerenden Entwicklung.
- Es gibt begründete Zweifel, dass die steigenden CO2 Emissionen durch Aktivitäten des Menschen bedingt sind. Auch zunehmende biologische Aktivität im Meer (und an Land) trägt zu den CO2 Emissionen bei.
- Womöglich ist der ganze CO2 Anstieg nur eine Folge einer natürlichen Erwärmung, und nicht etwa seine Ursache.
[1] genauer: H3O+ statt H+. Auch müssten in der Folge Aktivitäten statt Konzentrationen genommen werden – aber diese Feinheiten übergehen wir hier. Für schwache Säuren und Laugen ist letzteres ohnehin bedeutungslos.
[2] Das kleine „p“ in pH ist historisch bedingt, aber das H bezieht sich auf Wasserstoff. Entsprechend gibt es auch pOH für die OH–Ionen. Am Neutralpunkt ist pOH = pH = 7.
[3] alternativ kann für Lauge auch das Wort „Base“ genommen werden, und statt alkalisch findet auch „basisch“ Verwendung. Das Wort Lauge kommt daher, dass eine klassische Seifenlauge einen alkalischen pH-Wert hat. Auch nimmt man Natronlauge, also Ätznatron (=NaOH) gelöst in Wasser, zum „Ablaugen“ von alten Möbelstücken. Das Wort „alkalisch“ rührt daher, dass Natrium (Na) zur Gruppe der Alkalimetalle (Li, Na, K, Rb, Cs) gehört, die alle mit Wasser starke Laugen bilden.
[4] Pschyrembel Wörterbuch Pflege (2003), S. 517
[5] im Text wird, anders als in der Grafik gezeigt, sogar ein Absinken auf pH=7.65 genannt
[6] Feely erhielt in 2010 einen $100,000 Preis von der Heinz Family Foundation („Heinz-Ketchup“) der von Teresa Heinz, Ehefrau des US-Außenministers John Kerry), gegründet wurde, für seine „maßgebenden Arbeiten zur Meeresversauerung“.
[7] Water pH and temperature in Lake Biwa from MBT /CBT indices during the last 280 000 years, T. Ajioka et al., Clim. Past, 10, 1843–1855, 2014
[8] Auf der Webseite http://www.co2science.org/data/acidification/background.php wird eine Datenbank mit Artikeln zur Wirkung einer Meeresversauerung geführt. Nach den Betreibern der Webseite spräche etwa die eine Hälfte der Artikel für eine Schädigung, die andere Hälfte dagegen. Gewissheit sieht anders aus.
[9] Reef Water CO2 System and Carbon Production of Coral Reefs: Topographic Control of System-Level Performance, Atsushi SUZUKI and Hodaka K AWAHATA, Global Environmental Change in the Ocean and on Land, Eds., M. Shiyomi et al., pp. 229–248. (Download)
[10] Da aber der gegenwärtige Datensatz global ist, und PDO und das atlantische Gegenstück AMO (Atlantische Multidekadische Oszillation) um etwa 20 Jahre phasenverschoben sind, muss man wohl zumindest erst die pH Daten nach den Ozeanen aufschlüsseln. (Daten zu AMO, PDO, Korrelation mit Temperatur)
















Wir freuen uns über Ihren Kommentar, bitten aber folgende Regeln zu beachten:
- Bitte geben Sie Ihren Namen an (Benutzerprofil) - Kommentare "von anonym" werden gelöscht.
- Vermeiden Sie Allgemeinplätze, Beleidigungen oder Fäkal- Sprache, es sei denn, dass sie in einem notwendigen Zitat enthalten oder für die Anmerkung wichtig sind. Vermeiden Sie Schmähreden, andauernde Wiederholungen und jede Form von Mißachtung von Gegnern. Auch lange Präsentationen von Amateur-Theorien bitten wir zu vermeiden.
- Bleiben Sie beim Thema des zu kommentierenden Beitrags. Gehen Sie in Diskussionen mit Bloggern anderer Meinung auf deren Argumente ein und weichen Sie nicht durch Eröffnen laufend neuer Themen aus. Beschränken Sie sich auf eine zumutbare Anzahl von Kommentaren pro Zeit. Versuchte Majorisierung unseres Kommentarblogs, wie z.B. durch extrem häufiges Posten, permanente Wiederholungen etc. (Forentrolle) wird von uns mit Sperren beantwortet.
- Sie können anderer Meinung sein, aber vermeiden Sie persönliche Angriffe.
- Drohungen werden ernst genommen und ggf. an die Strafverfolgungsbehörden weitergegeben.
- Spam und Werbung sind im Kommentarbereich nicht erlaubt.
Diese Richtlinien sind sehr allgemein und können nicht jede mögliche Situation abdecken. Nehmen Sie deshalb bitte nicht an, dass das EIKE Management mit Ihnen übereinstimmt oder sonst Ihre Anmerkungen gutheißt. Wir behalten uns jederzeit das Recht vor, Anmerkungen zu filtern oder zu löschen oder zu bestreiten und dies ganz allein nach unserem Gutdünken. Wenn Sie finden, dass Ihre Anmerkung unpassend gefiltert wurde, schicken Sie uns bitte eine Mail über "Über Uns->Kontakt"Dieser Link (Eschenbach) ist meiner Meinung nach näher an der Realität …
http://tinyurl.com/lfaozb3
Er beschreibt die lokale Variation und inbesondere auch die Situation in der Tiefe.
@Dr. Paul #24
„Damit wird nicht eine „Versauerung“ verhindert, sondern umgekehrt bewirkt.“
Nö, denn HCO3- reagiert leicht basisch. Als Gegenionen sind ja hier Calciumionen vorhanden. .
Physikalisch gelöstes CO2 reagiert allerdings mit Wasser (neben der Bildung von HCO3-) unter Bildung von Hydroniumionen und die senken den pH.
JH
#21, #22 Auf meine Frage mit dem Kreislauf sind Sie eher nicht konsequent eingegangen. Wenn Sie auch aus dem „Karstabbau“ eine CO2 Senke machen wollen, ist dieser Kreislauf nicht mehr geschlossen, sondern führt zu einer permanenten CO2-Anreicherung im Meer auf Kosten der Atmosphäre. Damit wird nicht eine „Versauerung“ verhindert, sondern umgekehrt bewirkt.
Korallen würden daher langfristig zu einer Versauerung der Meere führen???
Das erinnert irgendwie an die ignorierte Rückkopplung der thermischen Ausgasung von CO2
durch den hypothetischen Erwärmungseffekt von CO2, der deshalb nicht existieren kann.
mfG
#21: Jürgen Hartung sagt: am Montag, 12.01.2015, 23:26
[ . . .] (Das von mir verlinkte Video ist übrigens unter meiner Anleitung geschaffen worden.)
JH
########################
Tolle Videos,
ich hofffe, diese werde in der Ausbildung (von wem auch immer) eingesetzt!
MfG
#20: Dr.Paul sagt:
am Montag, 12.01.2015, 22:38
#19:Herr Jürgen Hartung, mit „selbstverständlich“ würde ich etwas vorsichtiger sein!
Unsachlichkeit (ad hominem) ist immer verdächtig.
Dass hier viel gestritten wird habe ich ja selbst anfänglich gesagt.
Es geht doch nicht nur um den Klumpen, den keiner von Ihnen wirklich kennt.
Aber wenn ein Gebirge langsam verwittert, das findet typischerweise bei „Karst“ statt,
es wird flacher und voller „Hohlräume“,
dann haben Sie als Endergebnis weniger CaCO3 und statt dessen einen „Hohlraum“! Wo soll sich das aufgenommene CO2 da bitte verstecken?
#####################
Sehr geehrter Dr. Paul,
Sie hatten doch die Sache mit dem Karst vorgebracht: sympathisch finde ich die Tasache, dass sie nun nicht mehr munter Dinge behaupten sondern Fragen stellen, wie diese hier:
„Aber wenn ein Gebirge langsam verwittert, das findet typischerweise bei „Karst“ statt,
es wird flacher und voller „Hohlräume“, dann haben Sie als Endergebnis weniger CaCO3 und statt dessen einen „Hohlraum“! Wo soll sich das aufgenommene CO2 da bitte verstecken?“
Wie weiter oben schon aufgeführt ist die „Grundgleichung“ der Karstverwitterung die folgende:
„CaCO3 + CO2 + H2O reagiert zu (hin- und rückwärts) Ca2+ + 2 HCO3-“
Wenn man nun weiß, dass Karstquellen durchaus mittlere Schüttungen von bis zu 8000 l/s bei dabei eine Kalkfracht von 0,5 g/l aufweisen (können), dann sieht man dass diese Quellen pro Sekunde 4kg CaCO3 aus ihrem Einzugsgebiet als gelöste Fracht aus dem Einzugsgebiet entfernen.
Sie können gerne mal ausrechnen wie viele LKW-Ladungen Kalk da jeden Tage „den Bach runter gehen“. Die Sache mit den Hohlräumen halte ich damit für geklärt, ohne dass CO2 ausgasen muss.
Und das aus nur einer Karstquelle!
Gerne geschehen
MfG
Ketterer
P.S. Alles was ich über den Klumpen weiß ist, dass es kein CaCO3 ist, der Rest war nur eine „well educated guess“.
@Dr. Paul#20
Herr Dr. Paul, bitte lesen Sie nochmal, auf was sich mein „selbstverständlich“ in #19 bezieht.
Ihre Frage, „Wo soll sich das aufgenommene CO2 da bitte verstecken?“ beantworte ich mit:
Es läuft in Wasser gelöst als HCO3- samst Calciumionen über Flüsse, letztendlich in die Weltmeere und verhindert dort aufgrund seiner Pufferwirkung die Versauerung derselben.
Wenn Sie noch den Zeitfaktor der Karstbildung berücksichtigen funktioniert das auch bilanztechnisch.
Den Satz mit dem Klumpen verstehe ich nicht. (Das von mir verlinkte Video ist übrigens unter meiner Anleitung geschaffen worden.)
JH
#19:Herr Jürgen Hartung, mit „selbstverständlich“ würde ich etwas vorsichtiger sein!
Unsachlichkeit (ad hominem) ist immer verdächtig.
Dass hier viel gestritten wird habe ich ja selbst anfänglich gesagt.
Es geht doch nicht nur um den Klumpen, den keiner von Ihnen wirklich kennt.
Aber wenn ein Gebirge langsam verwittert, das findet typischerweise bei „Karst“ statt,
es wird flacher und voller „Hohlräume“,
dann haben Sie als Endergebnis weniger CaCO3 und statt dessen einen „Hohlraum“! Wo soll sich das aufgenommene CO2 da bitte verstecken?
Soviel Bilanz-Kopfrechnen muss schon sein.
Ausgangspunkt der Diskussion war ja die CO2-Senke durch biologische Neubildung von CaCO3.
Da ist eine zweite CO2-Senke beim Abbau nicht mehr drin, das schaffen nur „Grüne“.
Freundliche Grüße
(Arzt müsste man sein)
@Dr.Paul#17
„CaCO3 Solid + H2O… sieht ganz nach CO2 aus“
Herr Dr. Paul, youtube ist noch weniger zitier fähig als wiki!
Hier: http://tinyurl.com/llyltre stimmt allerdings die Überschrift. (auch der 3. Teilversuch zeigt, was CO2 in fester Form so alles kann, nämlich über 2000°C erzeugen!)
@ Sehr geehrter Herr Ketterer, Sie haben selbstverständlich in allen fachlichen Punkten in Ihrem Kommentar recht!
JH
######17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
#16: F.Ketterer nochmal Dank für die (partielle) Zustimmung in der Sache. Ihr gleichzeitiger Widerspruch ist daher mehr als merkwürdig.
[ . . . ]
########## F.Ketterer sagt ######
Merkwürdig?!?
Nochmals ganz langsam zum mitschrieben: Sie geben einige korrekte Trivia von sich.
Soweit so gut. Dann geht’s ans „Eingemachte“ und schon geben Sie Schmonzes von sich.
Und da setzt mein Widerspruch ein, ist doch ganz einfach und nicht merkwürdig..
###########17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
[ . . . ]
Richtig ist nur die relativ gute Löslichkeit….
[ . . . ]
############ F.Ketterer sagt ######
Fürs Protokoll: CaCO3 ins in Wasser (CO2freiem Wasser) quasi unlöslich (14mg / L)
#########17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
[ . . . ]
…Löslichkeit = „Verwitterung“ wobei CO2 wieder freigesetzt werden kann aber auch umgekehrt
[ . . . ]
############ F.Ketterer sagt ######
Es wird kein CO2 bei der Karstverwitterung von Kalkstein freigesetzt. „aber auch umgekehrt“ stimmt; das „aber“ sollten Sie streichen.
##############17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
[ . . . ]
H2O + CaCO3 = CO2 + Ca(OH)2
[ . . . ]
############ F.Ketterer sagt ######
Fürs Protokoll: Ihre Gleichung ist stöchiometrisch korrekt; wer daraus ableitet beide Seiten stünden im Gleichgewicht sollte sich mal die Reaktionsenthalpie zu Gemüte führen:
Ca(OH)2 + CO2 reagiert zu CaCO3 + H2O wobei dH = -27,4 kcal/mol (Angaben ohne Gewähr).
Das Gleichgewicht der Reaktion liegt also links und mit Nichten rechts.
###########17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
[ . . . ]
Karstgebirge bestehen nicht aus Ca2,
sondern, siehe meinen Link, aus „über 98 % CaCO3“!
[ . . . ]
############ F.Ketterer sagt ######
Wer redet von „Ca2“ ??
CaCO3 ist ein Salz (in Salzen liegt Ionenbindung vor) bestehend aus
Ca2+ und [CO3]2-
Schon vergessen (war im Chemiepraktikum dran).
Dieses Salz ist in Wasser (CO2freiem Wasser) fast unlöslich.
######17: Dr.Paul sagt: am Sonntag, 11.01.2015, 18:09
[ . . . ]
Was halten Sie denn von dem Filmchen,
CaCO3 Solid + H2O:
http://tinyurl.com/mjc8jf7
Sieht ganz nach CO2 aus. [ . . . ]
############ F.Ketterer sagt ######
Es bleibt dabei: Ein Teil vom dem was Sie von sich geben hat Hand und Fuß („sieht ganz nach CO2 aus“), aber dass Sie so kritiklos „CaCO3 Solid + H2O“ aus YouTube übernehmen spricht nicht für Ihr Chemiepraktikum. Der Versuch zeigt wohl eher die Reaktion von Trockeneis (CO2 solid) mit Wasser; es entsteht CO2, das als kaltes Gas -unter Nebelbildung mit der kalten Luft- nach unten fließt.
Sie fragen nach meinem fachmedizinischen Kommentar abgeben: kann ich nicht (in der Medizin bin ich Laie) aber in Ihrem Falle versuche ich eine Erklärung:
a) Ihr Chemiepraktikum liegt lange zurück und wie es aussieht wenn man (das in der Chemie übliche Kühlmittel) Trockeneis in einer wassergefüllte Wanne wirft, haben Sie vergessen.
b) Sie haben den in a) geschilderten Vorgang nicht vergessen; sie kennen ihn nicht, da ihr Chemiepraktikum nur an der Oberfläche kratzte.
c) Sie kennen den in a) geschilderten Vorgang und haben ihn nicht vergessen; nur Ihr Visus im mittleren Nahbereich ist nun Ihrem Alter entsprechend und Sie haben Ihre Lese/Gleitsichtbrille verlegt und das Video fehlinterpretiert.
Ich sehe (aller Wahrscheinlichkeit nach) in der wasser(?)-gefüllten Wanne Trockeneisbrocken in der Flüssigkeit liegen und aus der Wanne herausragen. Die CO2-Quelle ist damit doch wohl identifiziert.
Wenn Sie wirklich glauben was in dem Video gezeigt wird sein Kalk (solid CaCO3) oder Kalkstein, dann sollten mal jemand mit denen von Stuttgart21 reden: die wollen durch dieses Material Tunnelröhren bohren – ROTFL.
Damit bleibt es noch, dass Sie die Reaktionsbedingungen liefern, bei denen Karstverwitterung CO2 freisetzt: Ich bleibe dabei: Kalk braucht einen Säurebildner zur Verwitterung; meist ist dies CO2.
Die Reaktionsgleichung hatten wir ja schon:
„CaCO3 + CO2 + H2O reagiert zu (hin- und rückwärts) Ca2+ + 2 HCO3-“
#16: F.Ketterer nochmal Dank für die (partielle) Zustimmung in der Sache. Ihr gleichzeitiger Widerspruch ist daher mehr als merkwürdig.
Mein Satz :
„Richtig ist nur die relativ gute Löslichkeit = „Verwitterung“ wobei CO2 wieder freigesetzt werden kann aber auch umgekehrt“
ist absolut richtig.
Sie meinen, das wäre zu „medizinisch“?
Ist das immer noch zu medizinisch?:
H2O + CaCO3 = CO2 + Ca(OH)2
Karstgebirge bestehen nicht aus Ca2,
sondern, siehe meinen Link, aus „über 98 % CaCO3“!
Was halten Sie denn von dem Filmchen,
CaCO3 Solid + H2O:
http://tinyurl.com/mjc8jf7
Sieht ganz nach CO2 aus.
Auf Ihren fachmedizinischen Kommentar bin ich neugierig.
Ich weis schon, es gibt auch andere Reaktionsvarianten, worauf ich ja hingewiesen habe: „Da wird auch heftig bis heute gestritten.“
Sind wahrscheinlich auch alles Mediziner.
Nur die AGW-Vertreter nicht.
Die bevorzugen es,
dass die Menschen lieber krank werden,
oder absterben als Schädlinge.
Eines der vorrangigen Ziele der „Grünen“ weltweit.
#15: Dr.Paul sagt: am Samstag, 10.01.2015, 21:39
#14: F.Ketterer danke für die Zustimmung,
[ . . . ]
Wenn Sie etwas bei Chemie nicht verstanden haben, kann man bei Wiki auch Fragen stellen.
mfG
###########################
Sehr geehrter Dr. Paul,
Wenn Sie meinen Beitrag richtig lesen, dass finden Sie meine Zustimmung in diesen Punkten:
Korallen bilden Kalkstein
CaCO3 ist Kalkstein
Karst ist eine Folge der Kalksteinverwitterung.
Soweit die Trivialitäten; Bildungsniveau Klasse ca. 9/10 weiterführender Schulen.
Bei den Feinheiten erzählen Sie Schmonzes: „Richtig ist nur die relativ gute Löslichkeit“:
Kalk ist in erster Näherung fast unlöslich in Wasser; erst unter Zugabe von „Säurebildnern“ wird es zu Lösung des Kalkes kommen. Beim Karst beobachtet man:
„CaCO3 + CO2 + H2O reagiert zu (hin- und rückwärts) Ca2+ + 2 HCO3-
Nach dieser Formel sieht es ganz und gar nicht danach aus, als würde bei der Karstverwitterung CO2 freigesetzt, wie Sie behauptet haben:
„Richtig ist nur die relativ gute Löslichkeit = „Verwitterung“ wobei CO2 wieder freigesetzt werden kann aber auch umgekehrt“
Die Chemie ist doch hier kurz und knapp erklärt:
http://tinyurl.com/KarstChemie
Sie selbst hatten doch auf diese Seite verwiesen: was haben sie da anders verstanden als ich?
Ich weiß, dass man beim Wiki Diskussions-Tab auch Fragen stellen kann. Nur wenn man den Bögli schon kennt, erübrigt sich das. Nur: wenn Sie die Chemie hier nicht verstanden haben, wieso fragen Sie nicht und stellen stattdessen unsinnige Behauptungen auf?
Zu Ihrer Frage zum Zusammenhang mit der Medizin: eine einfache Antwort: Nur weil Mediziner Schmalspurpraktika in einem Teil der MINT-Fächer während ihres Grundstudiums machen müssen, sind sie per se noch nicht in der Position andere in den Naturwissenschaften belehren zu müssen. Und jetzt fragen Sie sich einmal, wieso ich das ausgerechnet Ihnen gegenüber äußere.
MfG
#14: F.Ketterer danke für die Zustimmung,
ich weis nur nicht, was das mit Medizin zu tun hat, wollen Sie mit Heinzow Konkurrenz machen?
Oder sind Sie auch Windmühlenbetreiber?
Dann könnte ich Ihre merkwürdige Feindschaft zu Ärzten verstehen:
http://tinyurl.com/pa5kozx
Traurig, dass die hierfür zuständigen komplett versagt haben.
Wenn Sie etwas bei Chemie nicht verstanden haben, kann man bei Wiki auch Fragen stellen.
mfG
#13: Dr.Paul sagt: am Freitag, 09.01.2015, 12:19
Noch einmal zu #11 und #12
Wenn schon Chemie:
Korallen bilden durch ihr Leben und Wachstum „Kalkstein“. Das ist chemisch nichts anderes als
CaCO3
http://www.chemie.de/lexikon/Kalkstein.html
[ . . . ]
Richtig ist nur die relativ gute Löslichkeit = „Verwitterung“ wobei CO2 wieder freigesetzt werden kann aber auch umgekehrt. Beides wird unter der Bezeichnung Karst zusammengefasst.
##########################
Wie nun: unser Mediziner begibt sich in die Niederungen der Chemie? Wie sagten Sie:
„Wenn schon Chemie:“ dann sollten wir doch Tatsachen benennen und nicht die medizinische Fantasie spielen lassen: Falsch ist es von einer guten Löslichkeit von Kalk (CaCO3) zu sprechen:
Kalk ist in Wasser schwerlöslich sagte schon D.Bücle weiter oben (wo er auch meinen stöchiometrischen Lapsus korrigierte).
Kalk (oder auch Kalkstein) ist nur in CO2-haltigem Wasser löslich.
Und auch das mit der Verwitterung bei der CO2 freigesetzt wird ist Schmonzes, das musste schon der Geologe Prof Ewert hier eingestehen.
CaC03 „verwittert“ nur in CO2-haltigem Wasser (wenn man von anders angesäuerten Wässern absieht). In der Natur ist Wasser in der Regel immer CO2-haltig, deswegen gibt es ja auch den Karst, das hatte Dr. Paul hingegen wieder Recht. Da Kalk zur Hydrogenkarbonat-Lösung verwittert setzt die Kalkverwitterung KEIN CO2 frei. Wurde in 12 ja schon beschrieben.
Aus #12 „CaCO3 + CO2 + H2O reagiert zu (hin- und rückwärts) Ca2+ + 2 HCO3-“.
Also wenn schon Chemie: dann sollte man sich auch als Mediziner eher mit Vorsicht der Sache nähern, damit die Fehler nicht die korrekten Aussagen überwiegen.
Noch einmal zu #11 und #12
Wenn schon Chemie:
Korallen bilden durch ihr Leben und Wachstum „Kalkstein“. Das ist chemisch nichts anderes als
CaCO3
http://www.chemie.de/lexikon/Kalkstein.html
„Als Kalkstein werden Sedimentgesteine bezeichnet, die ganz überwiegend aus den Mineralen Calcit und Aragonit (beide CaCO3) bestehen. Der größte Teil aller Kalksteine ist biogener Entstehung (von Lebewesen abgelagert)“
Es ist daher falsch Korallen direkt als CO2-Produzenten zu bezeichnen. Das Gegenteil ist offensichtlich der Fall.
Richtig ist nur die relativ gute Löslichkeit = „Verwitterung“ wobei CO2 wieder freigesetzt werden kann aber auch umgekehrt. Beides wird unter der Bezeichnung Karst zusammengefasst.
http://de.wikipedia.org/wiki/Karst
Da wird auch heftig bis heute gestritten.
mfG
@Peter Merbitz#9
Sehr geehrter Herr Merbitz ich stimme Ihnen ausdrücklich zu!
@F.Kettererä#9
Sehr geehrter Herr Ketterer, Sie sprechen mit Ihrem Beitrag indirekt die Kompliziertheit des Systems an:
Ich drehe mal Ihren 2. Satz – also Ihr Zitat aus dem Artikel – um:
CaCO3 + CO2 + H2O reagiert zu (hin- und rückwärts) Ca2+ + 2 HCO3-
Diese Gleichung beschreibt eigentlich, warum in unserer aller Wasserversorgung „hartes“ Wasser ankommt.
Also wäre diese System so eine CO2 Senke.
Die Lage der Gleichgewichte wird aber von mehreren Einflussgrößen geprägt: Temperatur, Konzentrationsverhältnisse, Druck (spielt hier keine Rolle) und von der Kinetik her von den Zeit, dh. in den Ozeanen auch von der Durchmischungszeit der Schichten.
So, und nun werden heutzutage mittels Computersimulationen – aus z. Tl. fragwürdigen Messwerten – entweder alarmistische oder vieleicht auch beruhigende Szenarien entwickelt.
Im Artikel wird mit dem Literaturverweis auf (9) übrigens die CO2 Produktion von Korallenriffen m.E. überzeugend dargestellt.
Die Gleichung aus #2
Ca2+ + HCO3- CaCO3 + H+ finde ich übrigens sehr „weit hergeholt“, als Bruttogleichung verschiedener Mechanismen allerding als möglich.
Lieber Admin, bitte entschuldigen Sie den Ausflug in die „Kirche der Chemie“. Man kann solche Details sicher nicht in diesem Forum klären. Aber vielleicht wäre dieses Thema mal einen Beitrag auf einer der nächsten EIKE-Konferenzen wert.
JH
@# 1, 2 und 7 (Kroll):
Bei der im Prinzip richtigen Aussage, dass Korallen beim Bau ihrer „Wohnsiedlungen“ CO2 produzieren, geht es darum, dass das Ca++ in Form von Carbonat einigermassen wasserunlöslich ist (1.5*10-3 %), währenddem es sich als Hydrogencarbonat zu ca. 2% relativ gut löst, besonders in Gegenwart von CO2. Die Korallen geben insofern CO2 ab, als sie aus dem „wasserlöslichen“ Hydrogencarbonat „wasserunlösliches“ Carbonat produzieren, wobei pro mol Carbonat ein mol des schrecklichen Treibhausgases generiert wird: Ca(HCO3)2 CO2 + H2O + CaCO3 .
Die Sache ist in Wirklichkeit insofern komplizierter, als das Ca-Hydrogencarbonat nur in Lösung und nur in Gegenwart von CO2 einigermassen beständig ist (im Sinne genannter Gleichgewichts-Formel, welche auch eine starke Vereinfachung darstellt). Global gesehen sind Korallen, Muscheln usw. natürlich als CO2-Emittenten irrelevant.
@#8 (F.Ketterer):
„Wer das so schreibt hat vergessen zu erklären woher das HCO3- kommt. Mein Vorschlag (ein erster, grober Schätzung):
H2O + CO2 reagiert zu (hin- und rückwärts) zu H2CO3 reagiert zu (hin- und rückwärts) zu 2HCO3- + 2H+.
H2CO3 reagiert (hin- und rückwärts)“ aber nicht wie von F.Ketterer beschrieben zu 2 HCO3- und 2 H+, sondern zu HCO3- und H+ , wobei die Formulierung des Protons in wässriger Lösung heute nicht mehr H+, sondern H3O+ ist.
#4 und 6 (Jürgen Hartung)
pH-Messung: photometrische pH-Messung ist Unsinn und ungenau. Erstens ist es eine Messung über einen Umweg, währenddem die potentiometrische Messung (mit „pH-Elektrode“) eine direkte Messung von [H3O+] darstellt. Zweitens muss für Photometrie der Indikatorfarbstoff hochrein sein, die Salinität des Wassers spielt eine Rolle für den Farbumschlag, und schon kleinste Trübungen stören die Photometrie. Die (ungefähre!!!) Genauigkeit von 0.0004 pH-Einheiten von Claiton et al. können Sie gleich vergessen. Carter et al. geben für die photometrische Methode 20 Jahre später eine Genauigkeit von 0.005 pH-Einheiten an.
VIS-Photometrie ist für eine pH-Messung niemals so zuverlässig und exakt und reproduzierbar wie die potentiometrische Methode (mit der Glas/Ag-AgCl-Elektrode). Selbstverständlich war in den 60er-Jahren eine pH-Messung mit den damaligen Analog-Messgeräten nichts Genaues. Ein normales pH-Meter für analytische Zwecke ist heute mit Digitalanzeige für 3 Nachkommastellen ausgerüstet. Und die zweite Stelle nach dem Komma kann man sehr wohl noch zuverlässig +/- pH 0.01 messen. Ablesen am Gerät kann man die Carter’schen 0.005 pH-Einheiten locker. Wichtig ist der Aspekt, dass falsche Messungen sowohl nach oben, als auch nach unten abweichen, sodass bei statistisch ausreichender Anzahl Messungen zu einem wahren Wert gemittelt werden kann.
Zur Sache an sich: Eine Versauerung der Ozeane ist insofern nicht möglich, als dass Unmengen CaCO3-Meeresgrund rein chemisch eine Versauerung nicht zulassen würden. Eine geringe pH-Verschiebung des Meerwassers in Richtung pH 7 halte ich beim Anstieg des atmosphärischen CO2-Gehaltes nicht für unplausibel, sondern eher für wahrscheinlich, sofern nicht entsprechend CO2 durch vermehrtes Algenwachstum gebunden wird.
#7:Hallo verehrter Herr Kroll, nur nicht so bescheiden, Sie haben natürlich recht,
Korallen bilden mit Hilfe von Symbiose (Photosynthese) biogenen Kalk, das ist daher in der Summe eine CO2-Senke.
Das sind die wachsenden Korallenriffe.
mfG
Man sollte das Korallenriff als Gesamtsystem betrachten. Erforderlich ungeachtet irgend welcher Albernheiten wäre eine Analyse der Stoffströme aller Komponenten. Die heterotrophen Organismen sind ja nicht nur die Korallenpolypen, es existiert hier eine sehr große Faunenvielfalt. Die CO2-Assimilation durch Karbonatbildung ist nur ein Prozess unter vielen. Ohne eine Bilanzsumme zu kennen halte ich es durchaus für möglich, dass in der Summe aller Stoffwechselprozesse des Systems tropisches Korallenriff ein CO2-Überschuss vorliegt.
Aus dem Artikel: (die Reaktions-Pfeile habe ich „verbalisiert)
„Ca2+ + 2 HCO3- reagiert zu (hin- und rückwärts) zu CaCO3 + CO2 + H2O
Da Calciumcarbonat (CaCO3, Kalkstein) in Wasser schwer löslich ist, fällt es aus. Dabei wird CO2 freigesetzt!“
###############################################
Wer das so schreibt hat vergessen zu erklären woher das HCO3- kommt. Mein Vorschlag (ein erster, grober Schätzung):
H2O + CO2 reagiert zu (hin- und rückwärts) zu H2CO3 reagiert zu (hin- und rückwärts) zu 2HCO3- + 2H+.
Folglich finde ich das „albern“ des Herr Kroll nicht wirklich abwegig. Ich möchte allerdings anmerken, dass dieser nicht sauber beschrieben Umstand schon in der Arbeit von Suzuki zu finden ist.
#3
Korallen sind, überwiegend, symbiotische Lebewesen.
Die Nesseltiere können meistens nicht ohne Photosynthese betreibende Algen, die sie im Körperinnern gefangen halten, nicht dauerhaft überleben. Natürlich gibt es auch strikte Raubtiere, die alles auffressen was in ihre nähe kommt, und alle Korallen verhalten sich wie Raubtiere nachts, oder wenn die Algen absterben. Trotzdem, in der Regel gilt: keine Algen, keine Großen Korallenriffe (ich generalisiere hier ein bisschen, natürlich gibt es auch Kaltwasserkorallen die in tiefen leben wo Sonnenstrahlen nicht mehr ankommen, die sich vom Plankton ernähren).
Der Artikel beschränkt sich außerdem ausschließlich auf diese symbiotische Arten, es wird explizit erwähnt das sie CO2 für Photosynthese verbrauchen.
Was Ich für Albern halte…
Nun erstens ist es schwer zu definieren was albern ist oder nicht, das liegt im Auge des Betrachters. Wenn aber jemand behauptet etwas das Gestein bildet, das CO2 chemisch dauerhaft bindet, und diese Gesteinsformation gigantisch genug ist um aus dem Weltall gesehen zu werden, und dann trotz dieser Tatsache behauptet dieses etwas wäre ein Klimasünder (CO2 Gesammtemitent), dann reserviere ich mir das recht dies albern zu nennen.
Auch wenn das ein Versuch sein sollte die Methoden der „Klimaapostel“ lächerlich zu machen, indem mann deren Logik irgendwo anwendet, wo der gesunde Menschenverstand sagt das dass so nicht stimmen kann, tut mir leid, auch dann erscheint es mir albern.
Ist aber nur meine persönliche Meinung.
MFG Kroll
Bitte meinen Beitrag #4 nicht falsch verstehen:
Ich habe bereits in den 70ern gelernt, dass beim pH-Wert die Angabe der zweiten Stelle nach dem Komma selbst unter Laborbedingungen rein akademischen Charakter hat. Bei Messungen in den Ozeanen dürften die Einflüsse wie Salinität, Temperatur sowie Art (es gibt ja die Bilder, wo ein Eimer von Bord eines Schiffes geworfen wird), Tiefe und Ort der Probenahme schon großen Einfluß auf die erste Nachkommastelle haben.
Also: „Wissenschaft des 21.Jahrhunderts halt“ ist durchaus zynisch gemeint.
JH
hallo,
#4:
Dann schaufeln sie mal den Ozean in einen Bruker!
Bei der Masse reicht Lackmuspapier
mfg
Danke Herr Dr. Steiner für den schönen Artikel. Sie haben es hier wirklich geschafft, ein komliziertes System sehr allgemein verständlich darzustellen.
Noch einen Hinweis:
„Moderne pH Messungen werden mit Glaselektroden durchgeführt, und da diese bereits seit etwa 100 Jahren bekannt sind, ist das Fehlen früherer Messungen besonders merkwürdig.“
Das mit den Glaselektroden stimmt nicht ganz: Seit den 90ern misst man „spektroskopisch“ (tinyurl.com/p5k2uhn), indem man einen Farbindikator verwendet (seit dem Altertum sind Farbindikatoren bekannt)nun aber die Absorptionsmaxima geräteanalytisch auswertet. So kommt man auf eine „precision“ von sage und schreibe 0,0004 pH-Einheiten!!!. Mit der Glaselektrode haben man schon bei 2 Stellen nach dem Komma unter Laborbedingungen Probleme.
Wissenschaft des 21. Jahrhunderts halt!
Freundliche Grüße
JH
#2: Kroll sagt:
„Korallen emittieren kein CO2. Die Behauptung ist albern..“
Korallen sind Nesseltiere, also ‚Kohlenstoffeinheiten‘ der Fauna!
Also wird u.a. ein Stoffwechselprodukt auch CO2 sein.
MfG
U.Hildebrandt
PS: Übrigens, was ist eine alberne Behauptung oder wie definieren sie solche?
Korallen emittieren kein CO2. Die Behauptung ist albern… Die Gleichung sollte korrekterweise berücksichtigen dass zwischen CO2 und HCO3- ein Gleichgewicht besteht. also sollte die Gleichung korrekterweise so aussehen: Ca2+ + HCO3- CaCO3 + H+. CO2 bleibt im Gestein chemisch gebunden. Etwas anderes zu behaupten auch wenn es ein Witz sein sollte, ist albern.
korallen sind natürlich keine „Klimasünder“… ich sehe keinen Grund wieso CO2 dass bei der Reaktion entsteht nicht sofort mit Wasser, das ja in Ozeanen reichlich zur Verfügung steht, weiter reagieren sollte zu H2CO3, und weiter zu HCO3- und H+… dass wäre auch logisch, da chemische Reaktionen Gleichgewichtsreaktionen sind. dieses kann mann dann aus der Ausgangsgleichung rauskürzen, und mann erhält: Ca2+ + HCO3- CaCO3 + H+