Warum Herden-Immunität bzgl. COVID-19 viel früher erreicht wird als gedacht
Das ,Herden-Immunitäts-Potential‘ [herd immunity threshold (HIT)] kann geschätzt werden aus der zugrunde liegenden Reproduktionsrate der Epidemie, R0 – eine Maßzahl, wie viele Menschen durch eine infizierte Person jeweils angesteckt werden können. Einfache Standard-Modelle epidemischen Wachstums implizieren, dass der HIT gleich ist {1 – 1/R0}. Ist der HIT erst einmal überstanden, beginnen Neu-Infektionen abzunehmen, was sicherstellen sollte, dass Gesundheitssysteme danach nicht zusammenbrechen und dass man wirksamer vorangehen kann, um die Krankheit zu eliminieren.
Allerdings schätzte der Ferguson20-Report, dass während der Epidemie 81% der Bevölkerung in UK und den USA infiziert werden würden, wenn man sich auf die Herden-Immunität verlässt, hauptsächlich über einen Zeitraum von 2 Monaten auf der Grundlage einer R0–Schätzung von 2,4. Diese Zahlen implizieren, dass Gesundheitssysteme doch zusammenbrechen würden mit der Folge von viel mehr Todesfällen. Die Studie behauptet, dass nur drakonische Maßnahmen der Regierung ein solches Szenario verhindern können. Sofort wurden derartige Maßnahmen in UK erlassen, ebenso wie in den meisten US-Staaten und verschiedenen anderen Ländern – in Gestalt höchst destabilisierender und restriktiver Lockdowns.
Eine bemerkenswerte Ausnahme war Schweden, wo man damit fortgefahren hat, eine auf Herden-Immunität basierende Strategie zu verfolgen. Das Team vom Imperial College schätzte, dass aufgrund der Mitte März eingeführten sehr moderaten Maßnahmen in Schweden R0 lediglich 2,5 betrug, mit einer Wahrscheinlichkeit von nur 2,5%, dass sie unter 1,5 lag (3). Die rapide Ausbreitung von COVID-19 in dem Land in der zweiten Märzhälfte zeigt, dass es unwahrscheinlich ist, dass R0 deutlich unter 2,0 lag (4).
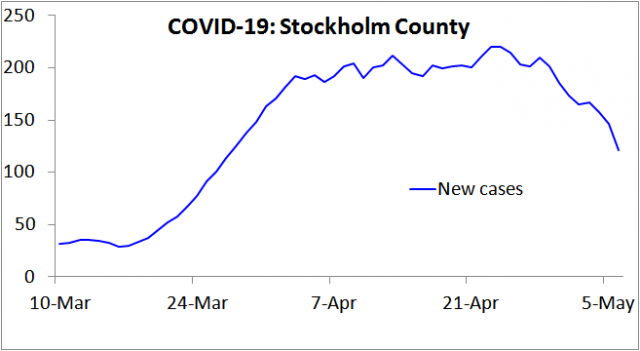
Sehr vernünftigerweise hat die schwedische Gesundheitsbehörde die Anzahl der Individuen im Auge gehabt, welche mit dem SARS-COV-2-Virus infiziert waren, und zwar mittels des PCR-Testverfahrens in Stockholm, wo COVID-19 erstmals aufgetreten war. Daraus leitete man die Schätzung ab, dass bis zum 11. April 17% der Bevölkerung infiziert wäre und bis zum 1 Mai 2020 25% (5). Aber dennoch hat die Anzahl neuer Fälle ab dem 11. April aufgehört zuzunehmen (Abbildung 1), ebenso Einweisungen ins Krankenhaus, und beider Anzahl ist seitdem signifikant gesunken. Dies belegt, dass der Höhepunkt am 11. April erreicht worden war, zu welchem Zeitpunkt nur 17% der Bevölkerung infiziert gewesen zu sein scheinen.
Wie kann es sein, dass der HIT in Stockholm mit nur 17% der Bevölkerung infiziert erreicht worden war, während ein R0 von 2,0 normalerweise einen HIT von 50% implizieren würde?
Die Bedeutung der Inhomogenität der Bevölkerung
Eine neue Studie von Gomes et al. (7) gibt die Antwort. Sie zeigt, dass Unterschiede zwischen den Individuen hinsichtlich ihrer Anfälligkeit für Infektionen und ihrer Neigung, andere anzustecken, dazu führen können, dass die HIT viel geringer ausfällt als in einer homogenen Population. Einfache Standard-Modelle bzgl. Epidemien berücksichtigen eine solche Variabilität nicht. Und das bei Ferguson20 herangezogene Modell scheint trotz seiner erheblich größeren Komplexität nur diejenigen Inhomogenitäten zu berücksichtigen, welche sich aus einer sehr begrenzten Anzahl von Faktoren ergeben – vor allem die geographische Separierung von Anderen sowie die Größe der Haushalte – woraus nur eine moderate Auswirkung auf die Verbreitung der Epidemie resultiert (8). Unter Verwendung eines so modifizierten Modells, dass es eine solche Variabilität berücksichtigt, wobei die Kovariabilität zwischen Anfälligkeit und Infektiosität wohl realistischer gehandhabt wird als bei Gomes et al., bestätige ich ihre Feststellung, dass der HIT tatsächlich auf einem viel niedrigeren Niveau erreicht wird als bei einer homogenen Population. Das würde erklären, warum der Höhepunkt in Stockholm schon Mitte April durchlaufen worden war. Gleiches scheint der Fall gewesen zu sein in anderen großen Städten und Regionen, welche stark von COVID-19 betroffen waren.
Man beachte in Abbildung 1, dass Tests bzgl. einer COVID-19-Infektion ab dem 11. März nur noch bei Menschen durchgeführt wurden, welche einer Behandlung im Krankenhaus bedurften, so dass seitdem nur ein kleiner Anteil an Infektionen als Fälle gemeldet wurden. Dies wäre die Ursache für das fehlende Wachstum in der ersten geplotteten Woche. Da Krankenhaus-Einlieferungen in der Regel erst mehrere Tage nach dem Auftreten von Symptomen erfolgen, vergrößert diese Änderung auch die Verzögerung zwischen Auftreten und Meldung einer Infektion als ein Fall. Dementsprechend wird die Zahl der Neuinfektionen, die im Durchschnitt etwa zwei Wochen zuvor aufgetreten sind, ab Mitte März mit einem Rückstand von 7 Tagen widerspiegeln.
…
[Es folgt eine längere Beschreibung der Verfahren und der Vergleiche der Verhältnisse in Stockholm mit denen anderswo mit vielen technischen Details. Diese Abschnitte werden hier bei der Übersetzung übersprungen, und es folgen die Schlussfolgerungen daraus. Anm. d. Übers.]
Conclusions
Wenn man in einem epidemiologischen Standard-Modell in vernünftiger Weise eine Inhomogenität in Bezug auf Anfälligkeit und Infektionsrate einbezieht, anstatt von einer homogenen Population auszugehen, führt dies zu einer sehr starken Senkung der Schwelle zur Herden-Immunität und auch des letztendlichen Infektionsniveaus, wenn die Epidemie danach einem ungehinderten Pfad folgt. Daher ist die Zahl der Todesfälle, die mit dem Erreichen der Herden-Immunität verbunden sind, viel geringer, als es sonst der Fall wäre.
Meiner Ansicht nach liegt die wahre Herden-Immunitätsschwelle wahrscheinlich irgendwo zwischen den 7% und 24%. Wenn sie bei etwa 17% läge, was aus dem Bezirk Stockholm bekannt ist, dürften die daraus resultierenden Todesfälle durch Infektionen vor Erreichen des HIT einen sehr geringen Anteil der Bevölkerung ausmachen. Die Sterblichkeitsrate bei Infektionen in Stockholm scheint bei etwa 0,4% zu liegen (20) und damit deutlich niedriger als nach den Schätzungen von Verity et al. (21), die in Ferguson20 verwendet wurden, mit einer Sterblichkeitsrate von weniger als 0,1% durch Infektionen bis zum Erreichen des HIT. Die Sterblichkeitsrate, um den HIT in weniger dicht besiedelten Gebieten zu erreichen, sollte niedriger sein, da R0 positiv mit der Bevölkerungsdichte zusammenhängt. (22) Dementsprechend sollten die Gesamttodesfälle bis zum Erreichen der Herden-Immunität deutlich unter 0,1% der Bevölkerung liegen. Obwohl es anschließend weitere Todesfälle geben würde, sollte es mit dem Schrumpfen der Epidemie immer praktikabler werden, ihr Ende durch Tests und Kontaktverfolgung zu beschleunigen, um die Ausbreitung von Infektionen zu verhindern und so die Zahl der weiteren Todesfälle in einem völlig ungemilderten Szenario erheblich unter die vom SEIR-Modell prognostizierte Zahl zu senken.
Remarks and References
[1] Neil M Ferguson et al., Impact of non-pharmaceutical interventions (NPIs) to reduce COVID-19 mortality and healthcare demand. Imperial College COVID-19 Response Team Report 9, 16 March 2020, https://spiral.imperial.ac.uk:8443/handle/10044/1/77482
[2] A final infection rate of 81% implies, in the context of a simple compartmental model with a fixed, homogeneous population, that the ‘effective R0‘ is between 2.0 and 2.1, and that the HIT is slightly over 50%. Ferguson20 use a more complex model, so it is not surprising that the implied effective R0 differs slightly from the basic 2.4 value that Ferguson20 state they assume.
[3] Flaxman, S. et al., Estimating the number of infections and the impact of non-pharmaceutical interventions on COVID-19 in 11 European countries. Imperial College COVID-19 Response Team Report 13, 30 March 2020, https://www.imperial.ac.uk/mrc-global-infectious-disease-analysis/covid-19/report-13-europe-npi-impact/
[4] Based on the Ferguson20 estimate of a mean generation time of 6.5 days, which appears to be in line with existing evidence, an R0 of 2.0 would result in a daily growth rate of 2.0^(1/6.5)= 11%. That is slightly lower than the peak growth rate in cases in late March in Stockholm County, and in early April in the two regions with the next highest number of cases, in both of which the epidemic took off slightly later than in Stockholm, and in line with the growth rate in Swedish COVID-19 deaths in early April
[5] https://www.folkhalsomyndigheten.se/contentassets/2da059f90b90458d8454a04955d1697f/skattning-peakdag-antal-infekterade-covid-19-utbrottet-stockholms-lan-februari-april-2020.pdf
[6] John Burn-Murdoch, Financial Times Research, 2 May 2020. http://web.archive.org/web/20200507075628/https:/twitter.com/jburnmurdoch/status/1256712090028576768
[7] Gomes, M. G. M., et al. Individual variation in susceptibility or exposure to SARS-CoV-2 lowers the herd immunity threshold. medRxiv 2 May 2020. https://www.medrxiv.org/content/10.1101/2020.04.27.20081893v1
[8] The 81% proportion of the population that Ferguson20 estimated would eventually become infected is only slightly lower than the 88% level implied by their R0 estimate of 2.4 in the case of a homogeneous population.
[9] https://en.wikipedia.org/wiki/Compartmental_models_in_epidemiology#The_SEIR_model
[10] Gomes et al. instead set the latent period slightly longer, to 4 days and treated it as a partly infectious period, unlike in the standard SEIR model.
[11] Li Q, Guan X, Wu P, et al.: Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. N Engl J Med. 2020; 382(13):1199–1207.https://www.nejm.org/doi/10.1056/NEJMoa2001316
[12] Once a SEIR model has passed its start up phase, and while a negligible proportion susceptible individuals have been infected, the epidemic daily growth factor is R0^(1/generation time), or 1.10–1.13 for R0=2.0–2.4 if the generation time is 7 days.
[13] L. Ferretti et al., Science 10.1126/science.abb6936 (2020).
[14] The coefficient of variation is the ratio of the standard deviation to the mean of its probability distribution. It is usual to assume a gamma distribution for infectivity, the shape parameter of which equals 1/CV2.
[15] Bi, Qifang, et al. “Epidemiology and transmission of COVID-19 in 391 cases and 1286 of their close contacts in Shenzhen, China: a retrospective cohort study.” The Lancet Infectious Diseases 27 April 2020. https://doi.org/10.1016/S1473-3099(20)30287-5
[16] Endo, Akira, et al. “Estimating the overdispersion in COVID-19 transmission using outbreak sizes outside China.” Wellcome Open Research 5.67 (2020): 67. https://wellcomeopenresearch.org/articles/5-67
[17] Lloyd-Smith, J O et al. “Superspreading and the effect of individual variation on disease emergence.” Nature 438.7066 (2005): 355-359. https://www.nature.com/articles/nature04153
[18] For computational efficiency, I divide the population into 10,000 equal sized segments with their common social connectivity factor increasing according to its assumed probability distribution, and allocate each population segment values for unrelated variability in susceptibility and infectivity randomly, according to their respective probability distributions.
[19] A highly susceptible but averagely infectious person is more likely to be removed from the susceptible pool early in an epidemic, reducing the average susceptibility of the pool. However, no such selective removal occurs for a highly infectious person of averagely susceptibility. Therefore, as Gomes et al. point out, variability in susceptibility lowers the HIT, but variability in infectivity does not do so except to the extent that it is correlated with variability in susceptibility.
[20] On 8 May 2020 reported total COVID-19 deaths in Stockholm County were 1,660, which is 0.40% of the estimated 413,000 of its population who had been infected by 11 April 2020. COVID-19 deaths reported for Stockholm County after 8 May that relate to infections by 11 April 2020 are likely to be approximately balanced by deaths reported by 8 May 2020 that related to post 11 April 2020 infections.
[21] Verity R, Okell LC, Dorigatti I, et al. Estimates of the severity of COVID-19 disease. medRxiv 13 March 2020; https://www.medrxiv.org/content/10.1101/2020.03.09.20033357v1.
[22] Similarly, the HIT may be significantly higher in areas that are very densely populated, have much less inhomogenous populations and/or are repeatedly reseeded from other areas. That would account for the high prevalence of COVID-19 infection that has been found in, for instance, some prisons and residential institutions or in city districts.
Link: https://www.nicholaslewis.org/why-herd-immunity-to-covid-19-is-reached-much-earlier-than-thought/
Übersetzt von Chris Frey EIKE
Hinweis in eigener Sache: Wegen mangelnder Sachkenntnis des Übersetzers ist bei dieser Übersetzung phasenweise eine Übersetzungsmaschine benutzt worden [Linguee].