Ein Experiment zur Ozean-Versauerung
Wird der Luft über der Wasseroberfläche CO2 hinzugefügt, wird erwartet, dass sich die Chemie des Wassers ändert, und der Schwerpunkt liegt beim pH-Wert des Säuregehaltes. Ich denke, dass die Änderung des pH-Wertes, wenn dieser sich im Gleichgewicht befindet, ziemlich leicht erfasst werden kann mit einem billigen, tragbaren pH-Meter mit einer Auflösung von 0,01, aber die gemessene Größenordnung des Effektes scheint signifikant geringer als in der neueren wissenschaftlichen Literatur genannt. In diesem Beitrag geht es zumeist um die Art der Durchführung des Experimentes nebst dessen Ergebnissen.
Aufbau des Experimentes
Eine schematische Übersicht des Experiment-Aufbaus zeigt die folgende Abbildung. Ein luftdichter 2-Liter-Vorratsbehälter enthält Luft und Meerwasser sowie tragbare, batteriebetriebene Instrumente zur Messung des pH-Wertes und des atmosphärischen CO2-Niveaus. Letzteres kann verändert werden mittels Einleitung von zusätzlichem CO2. Ein magnetischer Rührapparat mischt beides fortwährend.
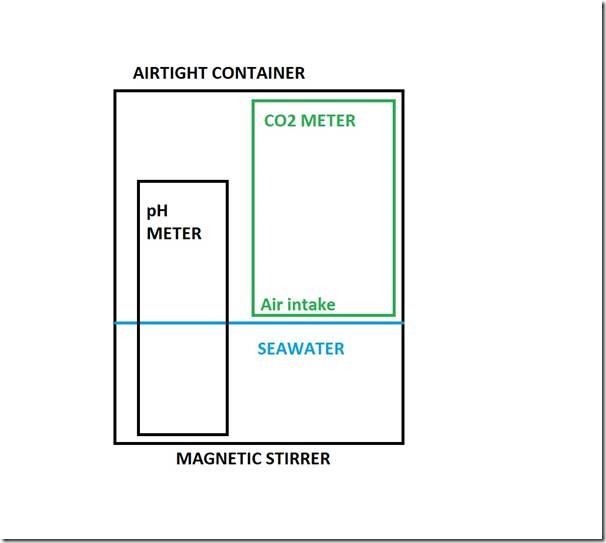
Den tatsächliche Experiment-Aufbau zeigt das folgende Foto. Der pH-Messer ist weiß und der CO2-Messer grau. Dessen Röhrchen zur Einleitung von Luft ist unmittelbar über der Wasseroberfläche erkennbar. Die Technologie der Einlagerung von Lebensmitteln bietet der luftdichte 2-Liter-Container, der Plastik-„Tisch“ hält den CO2-Messer gerade über CO2 Wasseroberfläche, und eine Schutzhülle verhindert, dass der CO2-Messer nass wird. Ein Loch darin stellt die Luftzufuhr sicher. Weitere Details am Ende des Beitrags.

Der ursprüngliche Plan war, einen kleinen tragbaren Elektro-Ventilator zur Durchmischung der Luft einzusetzen, doch stellte sich heraus, dass die Batterien nach einer Stunde leer waren. Diese Zeit reichte nicht, um ein pH-Gleichgewicht zu erreichen, was etwa 10 Stunden dauert.
CO2-Herstellung und -Zuführung
CO2 wurde erzeugt mittels Hinzufügen von Essig zu Natron in einem Becher (mit Spritzschutz). Dann wurde es mittels einer ungebrauchten Spritze in die Apparatur injiziert:

In einem zugfreien Raum kann man sich das im Becher erzeugte CO2 als eine relativ dichte Flüssigkeit vorstellen, welche dort verbleibt. Es kann in eine geeignete Vorrichtung gesaugt und dem 2-Liter-Glascontainer hinzugefügt werden. Ziel ist eine Anreicherung der Luft mit etwa 1000 ppm CO2, also ein Teilchen pro Tausend, d. h. 2 ml CO2 bei atmosphärischem Luftdruck, welcher einfach hergestellt und eingefangen werden kann.
Meerwasser
Meerwasser-Stichproben von jeweils etwa 450 ml wurden an der Küste nahe Weymouth in Dorset geschöpft, das liegt an der Südküste von England. In der Brandungszone gab es einigen Seetang, was den pH beeinflussen könnte. Jede Stichprobe wurde im „Labor“ eine Nacht lang in einer versiegelten, 500 ml fassenden Glasflasche gelagert, um das Meerwasser auf die Lufttemperatur dortselbst zu bringen.
Vorläufige Ergebnisse
Jedes Experiment erstreckte sich über 12 Stunden, was in etwa der beobachteten Zeit entspricht, die zur Erreichung eines pH-Gleichgewichtes erforderlich ist. Dabei wurde alle 15 Minuten eine Messung durchgeführt. Die Läufe begannen am Vormittag bis etwa 22 Uhr, über einen Zeitraum also, in welchem die Lufttemperatur im Labor ziemlich konstant bleibt.
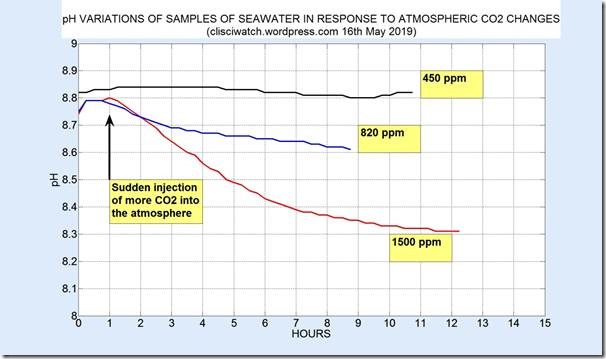
Die folgende Graphik zeigt frühe Ergebnisse für 3 Läufe, einen ohne Zuführung von CO2 (oberste Kurve), eine mit Zufügung von CO2 bis zu einer Anreicherung von etwa 820 ppm (dargestellt in blau mit einer konstanten +0,2-Verschiebung aller pH-Werte, und schließlich das Ergebnis für eine Anreicherung bis etwa 1500 ppm:
Diskussion
Falls die gegenwärtige Rate der CO2-Zunahme in der Atmosphäre von etwa 2,4 ppm pro Jahr andauert, dann wird der Gehalt zum Ende des 21. Jahrhunderts etwa 600 ppm betragen mit einer Änderung des pH-Wertes von Meerwasser um etwa 0,15. Das ist deutlich weniger als die in der wissenschaftlichen Literatur angeführten Werte. Man beachte, dass die pH-Änderung um 0,15 im Meerwasser mit einem pH von 8,8 ermittelt worden ist, was sich am oberen Ende der beobachteten Bandbreite befindet. Die Wasserstoff-Ionen-Konzentration bei einem pH von 7,8 ist zehnmal höher als bei einem pH von 8,8, so dass die Änderung in Meerwasser mit einem pH von 7,8 sogar niedriger liegen kann als 0,15.
EQUIPMENT DETAILS
· pH meter: Hanna Instruments HI 98108
· CO2 meter: Kane-alert- CO2
· Magnetic Stirrer: Hanna Instruments HI 190M
Anmerkung
Wasser in einem geschlossenen Behälter ergibt 100% Relative Feuchtigkeit, und Kondesation könnte eventuell die Leitfähigkeit des Messinstruments beeinflussen. Daher wurde alles nach jeder Messung sorgfältig getrocknet.
Weitere Informationen
Auf dieser Website kann man die Entwicklungen verfolgen und auch Kommentare abgeben.
Link: https://wattsupwiththat.com/2019/05/17/an-ocean-acidification-experiment/
Übersetzt von Chris Frey EIKE